Transfer RNA (Gm18) メチル化酵素に保存されている
塩基性アミノ酸残基は役割分業していた!

Transfer RNA (Gm18) メチル化酵素 (TrmH) は、
tRNAのD-loopに保存されているグアニン18の
リボースの2'-OH基をメチル化する酵素です。
この酵素の仲間(SpoU family)は、C末のポリペプチドが
タンパク質のループ構造を縫った構造(トレフォイル・ノット
構造)をもっていて、タンパク質フォールディングの上から
も、着目されています。
当研究室では、東京工業大学、東京大学、理化学研究所と
共同で、この酵素の機能と構造の解析を進めています。
今回は、この共同研究シリーズの第4弾として
保存されている塩基性アミノ酸残基に着目しました。
次いで、これらのアミノ酸残基すべてをアラニンに置換し、tRNAへの親和性やメチル基転移活性が
どう変化するかを調べました。
酵素キネティック解析の結果と、ゲル・モビリティ・シフト・アッセイの結果から、各々、tRNAに
対するKmとKdを求めたところ、(i) Kdのみが変化するアミノ酸残基と(ii) KmとKdの両方が変化する
アミノ酸残基が区別できることがわかりました。
これは、TrmHの場合、メチル基転移反応後にメチル化されたtRNAが解離する速度が、かなり遅い
ため、それが律速段階となり、二つが区別できると解釈できます。
すなわち、(i)に属するアミノ酸残基群は、tRNA結合の初期段階で必要で、
(ii) に属するアミノ酸残基群は、触媒サイクルの進行に必要だと解釈できます。
これまで、まったく謎だったトレフォイル・ノット構造をもつRNAメチル化酵素の触媒メカニズムの
一端が判ったことにより、tRNAやリボソームRNAが成熟する過程に新知見が加わりました。
病原性微生物が、チオストレプトンなど抗生物質に耐性を獲得するメカニズムの解明にも
つながる発見です。
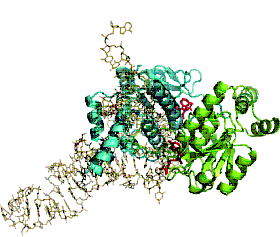
まず、我々は、TrmHとtRNAのドッキングモデルを作成し、保存されている塩基性アミノ酸残基が
モデル上でどこに位置するかを調べました。
注目した塩基性アミノ酸残基は、すべてTrmHの分子表面上にあり、モデル上ではtRNAと
接触しうることが確認できました。
これらの情報をもとに、TrmHのみの構造とTrmH-AdoMet複合体の構造を比較したところ、
(ii)に属するアミノ酸残基群は、AdoMet結合にともなって、溶媒側に開いていることが
わかりました。