TrmHは、tRNAの保存ヌクレオチドG18を認識して、G18のリボースをメチル化する酵素です。
G18は、tRNA中ではU55(多くの場合、PseudoU55)と水素結合を形成しており、L字型構造の
内側に埋め込まれています。
したがって、TrmHがG18のリボースをメチル化するためには、
(1)L字型tRNAに結合する
(2)tRNAを構造崩壊させて、埋め込まれたG18のどこかを認識する
という、少なくとも、2つのステップが必要です。
このアイデア自身は、今にはじまったことではなく、私(堀)が大学院生の頃から考えていました。
しかし、実際にそれを証明するとなると、とてつもなく、大変でした。
この論文は、越智さんが4年間の時間をかけ、試行錯誤を重ねた大長編です。
完成してみると、RNA修飾酵素で、誰もやったことのないPre-steady-state kinetic解析の論文となりました。
技の種類が多いのも、この論文の特徴です。
数々の古典的RNA分析手法、秒単位のアッセィ、Stopped-flow蛍光測定といった物理化学解析を
コンビネーションで使いました。
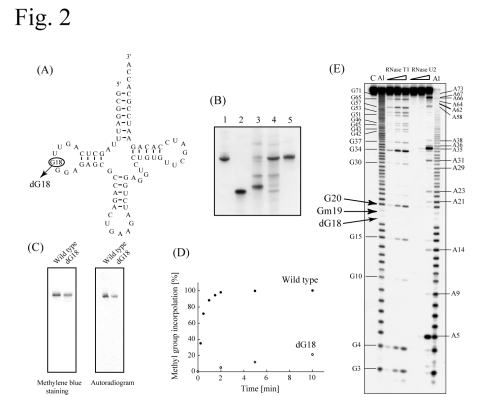
問題提起のdG18改変tRNAのメチル化の図
ふつう、メチル化部位のG18をデオキシ体(dG18)に変えたら、メチル化反応が停止しそうです。
ところが、予想に反して、この変異体では、効率が悪いものの隣のG19のメチル化が起こります。
TrmHは、tRNA中にたくさんあるグアノシンの中から、どうやってメチル化サイトを決めているのでしょうか?